
Auf der Suche nach dem Verständnis des Universums bildet die Erforschung von Atomen und Molekülen einen Eckpfeiler der modernen Wissenschaft. Von den antiken philosophischen Konzepten bis hin zur Spitzenforschung in der Quantenmechanik, war die Entdeckung dessen, was Materie ausmacht, stets eine faszinierende Reise.
Dieser Artikel taucht ein in die komplizierte Welt der Atome und Moleküle, erkundet deren Struktur, Wechselwirkungen und die grundlegenden Kräfte, die ihre Existenz bestimmen.
Das Wichtigste in Kürze
- Atome sind die grundlegenden Bausteine der Materie, bestehend aus einem positiven Kern und einer negativen Hülle.
- Moleküle entstehen durch die Verbindung von Atomen und sind ebenfalls elektrisch neutral.
- Die Atomphysik hat maßgeblich zur Entwicklung der Quantenmechanik und des modernen Verständnisses von Materie und Energie beigetragen.
- Quantenphysik und elektromagnetische Kräfte sind entscheidend für das Zusammenhalten von Atomen und Molekülen.
- Die Erforschung von Atomen und Molekülen eröffnet tiefe Einblicke in das Zusammenspiel von Kräften und Partikeln, die unsere physische Realität und das Universum prägen.
Die Grundlagen des Atoms
Die Materie ist aus Atomen aufgebaut, unabhängig davon, ob sie lebt oder nicht.
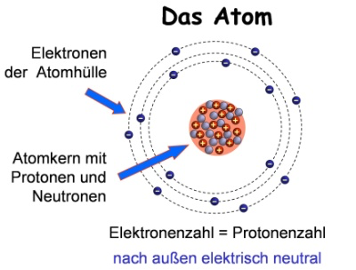
Ein Atom wird als grundlegender, elektrisch neutraler Bestandteil der Materie definiert. Sein Zentrum bildet der Atomkern, der mindestens ein Proton – ein positiv geladenes Teilchen mit signifikanter Masse – enthält.
Die Neutralität des Atoms ergibt sich aus dem Gleichgewicht zwischen den positiven Protonen im Kern und den ebenso zahlreichen, jedoch masselosen negativen Elektronen, die in einer umgebenden Hülle angeordnet sind. Zudem sind Neutronen, neutrale Partikel ohne elektrische Ladung, oft Teil des Kerns und tragen zur Stabilität des Atoms bei.
Kern und Elemente
Der Atomkern eines Elements setzt sich aus Protonen sowie häufig aus einer ähnlichen oder größeren Anzahl von Neutronen zusammen. Diese Neutronen sind ungefähr gleich schwer wie Protonen, besitzen jedoch keine elektrische Ladung. Diese Kernkonstellation ist ausschlaggebend für die Identität des chemischen Elements, da die Protonenzahl das Element im Periodensystem festlegt.
Die Bildung von Molekülen
Die Atome verbinden sich wiederum zu Molekülen.
Moleküle sind Strukturen, die ebenfalls elektrisch neutral sind. Sie unterscheiden sich von Atomen dadurch, dass sie aus mehreren Atomkernen zusammengesetzt sind. Die Bindungen innerhalb von Molekülen entstehen durch Wechselwirkungen in der Elektronenhülle der beteiligten Atome.
Ein Molekül setzt sich aus zwei oder mehreren Atomkernen zusammen und verfügt über eine gemeinsame Elektronenhülle, in der die Elektronen der verbundenen Atome interagieren. Diese Elektronenkonfiguration ermöglicht die chemische Verbindung oder Trennung der Atome durch spezifische chemische Reaktionen.
Beispiel: Sauerstoff und Schwefel
Um den Unterschied zwischen Atom und Molekül zu veranschaulichen, nehmen wir Sauerstoff: Jedes Atom hat in seinem Kern 8 Protonen und in der Regel 8 Neutronen, umgeben von 8 Elektronen.
Ein Sauerstoffmolekül (O2) besteht aus zwei solchen Kernen, umgeben von einer Elektronenwolke mit insgesamt 16 Elektronen. Würden diese Kerne zu einem verschmelzen, entstünde ein Kern mit 16 Protonen und meist 16 Neutronen.
Ein Kern mit diesen Merkmalen findet sich im Element Schwefel, das im Periodensystem direkt nach Sauerstoff steht und ebenfalls 16 Protonen im Kern aufweist. Schwefel und Sauerstoff weisen trotz ähnlicher Protonenzahl grundlegend verschiedene chemische und physikalische Eigenschaften auf. Die Kernverschmelzung oder -teilung findet nur unter extremen energetischen Bedingungen statt.
Historischer Kontext und moderne Entdeckungen
Für die alten Griechen war einst das „atomos“ (altgriechisch ἄτομος, unteilbar) das kleinste denkbare Teilchen für die ihnen vertraute Materie. Und in der Tat besteht alle uns geläufige Materie, d.h. alle alltäglichen festen, flüssigen oder gasförmigen Stoffe, aus unzähligen Atomen.
Im 20. Jahrhundert wurde die Unteilbarkeit der Atome, wie sie ursprünglich vermutet wurde, widerlegt. Ernest Rutherford entdeckte 1911 durch seine bahnbrechenden Streuexperimente, dass Atome
- einen dichten, positiv geladenen Kern
- und eine umgebende, negativ geladene Elektronenhülle
aufweisen müssen.
Ein Atom repräsentiert die kleinste Einheit eines chemischen Elements.
Aktuell sind 118 Elemente bekannt, von denen ungefähr 90 natürlich auf der Erde existieren. Die Atome dieser Elemente variieren in Größe und Masse. Entscheidend ist jedoch ihre chemische Reaktivität, also die Fähigkeit, mit anderen Atomen Verbindungen einzugehen, die zu Molekülen oder kristallinen Strukturen führen.
Die Eigenschaften des Atomkerns
Obwohl der Atomkern nur einen Bruchteil des Durchmessers der Atomhülle einnimmt – etwa 20.000 bis 150.000 Mal kleiner –, enthält er über 99,9 % der Gesamtmasse des Atoms.
Die Dichte des Kerns, also das Verhältnis seiner Masse zu seinem Volumen, bleibt mit rund 2·1017 kg/m³ konstant hoch.
Zum Vergleich: Würde man den Eiffelturm auf die Größe eines Sandkorns komprimieren, erreichte man eine ähnliche Dichte.
Die Bindung zwischen dem positiv geladenen Kern und der negativ geladenen Hülle resultiert aus elektrostatischen Kräften, die diese beiden entgegengesetzten Ladungen anziehen.
Die Rolle der Atomphysik
Die Atomphysik untersucht nicht nur den strukturellen Aufbau der Atome, sondern auch interne Prozesse sowie deren Interaktionen mit anderen Atomen. Diese Disziplin war grundlegend für den Fortschritt in der modernen Physik und spielte eine Schlüsselrolle bei der Entstehung der Quantenmechanik. Sie lieferte Einblicke, die essentiell für das Verständnis quantenmechanischer Phänomene sind.
Quantenphysik und elektromagnetische Kräfte
Was Atome und Moleküle zusammenhält, sind Quantenphysik und elektromagnetische Kräfte, also dieselben Kraftfelder, aus denen auch Licht besteht; in der Quantentheorie werden alle diese Kräfte durch den Austausch von virtuellen Lichtteilchen vermittelt.
Ein Universum ohne Licht würde insofern gar nicht existieren. Raum und Zeit, Materie und Sinne sind im Grunde alle nichts ohne das Licht.
Schlussgedanken
Die Erforschung von Atomen und Molekülen erschließt weit mehr als die materiellen Grundbausteine des Universums. Sie ermöglicht Einblicke in das Zusammenspiel von Kräften und Partikeln, die unsere Welt formen.
Beginnend mit dem antiken Konzept des ‚Atomos‘, hat sich dieses Forschungsfeld zu einem umfassenden Bereich entwickelt, der sowohl die physische Realität als auch das faszinierende Feld der Quantenphänomene umfasst. Diese fortlaufende Entdeckungsreise erweitert unser Verständnis für die Komplexität und Vielfalt des Universums.













